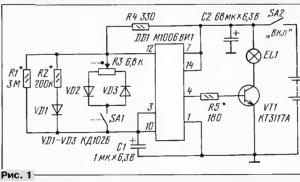
Схема установки получения водорода из алюминиевого сплава. Производство водорода из алюминия
Изготовлен генератор, представляющий собой герметичную емкость с внутренним объемом 220 мл и отделяемой крышкой, в которой находятся герметичные, изолированные токоподводы-крепления для алюминия и газоотводная трубка для отвода водорода. В генератор заливают 200 г раствора поваренной соли концентрацией 17 Закрепляют к токоподводам-креплениям алюминиевые пластины площадью 13 см 2 каждая. Закрывают генератор крышкой, убедясь в герметичности. После чего подают напряжение на токоподводы. Для более быстрого удаления оксидной пленки с поверхности алюминия в начале подается напряжение до 1,5 В. После деструкции оксидной пленки понижают напряжение до рабочей величины. Для работы генератора выбран диапазон напряжений 0,3-1,5 В, так как при этих значениях напряжения характеристика G/W), выше, чем при больших или меньших значениях напряжения, что позволяет более рационально использовать электроэнергию, но генератор водорода может работать и в более широком диапазоне напряжений.
Предлагаемый способ можно реализовать более эффективно
Для увеличения выхода водорода при тех же значениях мощности можно применить многоэлектродную систему в одной ячейке три электрода между отрицательным и положительным электродами располагается пассивный электрод, и так две ячейки, получен более высокий результат. Также в качестве восстановителя можно использовать дисперсный алюминий, что позволяет повысить выход водорода.
В результате испытания генератора по методике примера 1 заливают в генератор с двумя алюминиевыми электродами 200 г морской воды. Полная площадь каждого электрода 13 см 2. В результате получены следующие результаты: выход водорода при 1,5 В 0,5 л/ч, выход относительно энергии при 1,5 В 0,52 Вт/ч.
При увеличении общей концентрации солей упариванием увеличивается выход водорода во времени и относительно затраченная энергия достигает максимума 16-23 солей морской воды. Данный способ позволяет обеспечить равномерное получение водорода и позволяет регулировать его выход с требуемым потребителю расходом.
Формула изобретения
Способ получения водорода, включающий взаимодействие алюминия с водным раствором галогенида щелочного или щелочноземельного металла, отличающийся тем, что, с целью обеспечения возможности регулирования выхода водорода, взаимодействие осуществляют при одновременном пропускании электрического тока через реакционную смесь сначала при напряжении 1,5 В, а после удаления оксидной пленки напряжение снижают до 0,3 В.
Получение водорода в домашних условиях
 Способ 1.
Насыпаем в колбу небольшое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся.
Способ 1.
Насыпаем в колбу небольшое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся.
Дождавшись пока реакция будет происходить более активно, аккуратно добавим еще 10г. щелочи и несколько кусочком алюминия. Так мы значительно усилим процесс. Закупориваем колбу, пробиркой с трубкой ведущей сосуд для сбора газа. Ждем примерно 3 -5 мин. пока водород вытеснит воздух из сосуда.
Как образуется водород? Оксидная пленка, которая покрывающая поверхность алюминия, при контакте с щелочью разрушается. Так как алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6h3O → 2Na + 3h3
Способ 2. Водород из алюминия, сульфата меди и пищевой соли.
В колбу насыпаем немного сульфата меди, и соли. Добавляем воду и перемешиваем до полного растворения. Раствор должен, окрасится в зеленый цвет, если этого не произошло, добавьте еще небольшое количество соли. Колбу необходимо поставить в чашку наполненной холодной водой, т.к. при реакции, будет выделятся большое количество тепла. Добавляем в раствор несколько кусочков алюминия. Начнется реакция.
Как происходит выделение водорода? В процессе образуется хлорид меди, смывающий оксидную пленку с метала. Одновременно с восстановлением меди происходит образование газа.
Способ 3. Водород из цинка и соляной кислоты.
Помещаем в пробирку кусочки цинка и заливаем их соляной кислотой. Являясь активным металлом цинк, взаимодействуя с кислотой, вытесняет из нее водород.
Zn + 2HCl → ZnCl2 + h3
Способ 4. Производство водорода электролизом.
Пропускаем через раствор воды и проваренной соли электрический ток. При реакции, будет выделятся водород и кислород.
Водород уже достаточно давно рассматривается и кое-где используется в качестве экологически чистого вида топлива. Но более широкому использованию водородного топлива мешает целый ряд неразрешенных на сегодняшний день проблем, главными из которых являются хранение и транспортировка. Однако, группа исследователей из американской Армейской научно-исследовательской лаборатории, проводя эксперименты на Абердинском испытательном полигоне близ Мериленда, сделала случайное открытие. Пролив воду на брусок особого алюминиевого сплава, состав которого держится пока в секрете, исследователи заметили мгновенно начавшийся процесс бурного выделения водорода.
Из школьного курса химии, если кто его еще помнит, водород является побочным продуктом реакции между водой и алюминием. Однако, данная реакция обычно протекает лишь при достаточно высокой температуре или в присутствии специальных катализаторов. Да и тогда она идет достаточно "неторопливо", на заполнение бака водородного автомобиля потребуется около 50 часов, а энергетическая эффективность такого метода получения водорода не превышает 50 процентов.
Все вышесказанное не имеет отношения к реакции, в которой принимает участие новый сплав алюминия. "Эффективность этой реакции вплотную приближается к 100 процентам, а сама реакция "разгоняется" до максимальной производительности менее, чем за три минуты" - рассказывает Скотт Грендаль, руководитель научной группы.
Использование системы, вырабатывающей водород по мере необходимости, решает массу имеющихся проблем. Воду и алюминиевый сплав легко транспортировать из одного места в другое, оба этих вещества сами по себе инертны и стабильны. Во-вторых, для начала реакции не требуется никакого катализатора, ни первоначального толчка, реакция начинает идти сразу же, как вода входит в контакт со сплавом.
Все вышесказанное еще не означает, что исследователи обнаружили панацею в области водородного топлива. В этом деле существует еще целый ряд вопросов, подлежащих выяснению или уточнению. Первым вопросом является то, будет ли работать такая схема получения водорода вне лаборатории, ведь существует множество примеров, когда экспериментальные технологии отлично работают в лабораторных условиях, но терпят полную неудачу при полевых испытаниях. Вторым вопросом является вопрос сложности и стоимости производства алюминиевого сплава, стоимость утилизации продуктов реакции, которые станут факторами, определяющим экономическую целесообразность нового способа получения водорода.
И в заключение следует отметить, что на выяснение упомянутых выше вопросов, скорее всего, уйдет не так уж и много времени. И только после этого можно будет сделать выводы о дальнейшей жизнеспособности нового метода получения водородного топлива.
Источники: www.ntpo.com, all-he.ru, h3-o.sosbb.net, 505sovetov.ru, dailytechinfo.org, joyreactor.cc
Кракен – гигантский осьминог
Гигантские крысы
Загадочные вирусы
Видение Джуд-Хаэля. Девушка с небес
Где предпочтительно остановиться в Москве

Москва - огромный мегаполис, ежедневно встречающий многочисленных приезжих. Кто-то отправляется сюда с экскурсионным визитом, у кого-то цель – деловая поездка. Удобство...
Китайская культура - древняя цивилизация

Согласно утверждению китайского ученого Лян Цичао, Китай вместе с Вавилоном, Индией и Египтом является одной из четырех древних цивилизаций. Эта большая...
Философия Древнего Востока

Особенности направлений древнеиндийской философии: брахманизм; философия эпического периода; неортодоксальные и ортодоксальные школы. Школы и направления древнекитайской философии: конфуцианство; даосизм; моизм; легизм; ...
Активный металл. Он устойчив на воздухе, при нормальной температуре быстро окисляется, покрываясь плотной пленкой оксида, которая защищает металл от дальнейшего разрушения.
Взаимодействие алюминия с другими веществами
При обычных условиях не взаимодействует с водой даже в состоянии кипения. При удалении защитной оксидной пленки алюминий вступает в энергичное взаимодействие с водяным паром воздуха, превращаясь в рыхлую массу гидроксида алюминия с выделением водорода и тепла. Уравнение реакции:
2Al + 6H₂O = 2Al(OH)₃ + 3H₂
 Гидроксид алюминия
Гидроксид алюминия
Если снять защитную оксидную пленку с алюминия, то металл вступает в активное взаимодействие с . При этом порошок алюминия сгорает, образуя оксид. Уравнение реакции:
4Al + 3O₂ = 2Al₂O₃
Этот металл также активно взаимодействует со многими кислотами. При реакции с соляной кислотой наблюдается выделение водорода:
2Al + 6HCl = 2AlCl₃ + 3H₂
При обычных условиях концентрированная азотная кислота не взаимодействует с алюминием, так как будучи сильным окислителем, она делает оксидную пленку еще крепче. По этой причине азотная кислота хранится и перевозится в алюминиевой посуде.
 Транспортировка кислот
Транспортировка кислот
Алюминий при обычной температуре пассивируется разбавленной азотной и концентрированной серной кислотами. В горячей серной кислоте металл растворяется:
2Al + 4H₂SO4 = Al₂(SO4)₃ + S + 4H₂O
Взаимодействие с неметаллами
Алюминий реагирует с галогенами, серой, азотом, и всеми неметаллами. Для протекания реакции необходимо нагревание, после чего взаимодействие происходит с выделением большого количества тепла.
Взаимодействие алюминия с водородом
Алюминий непосредственно с водородом не реагирует, хотя известно твердое полимерное соединение алан , в котором существуют так называемые трехцентровые связи. При температуре выше 100 градусов Цельсия алан необратимо разлагается на простые вещества. Гидрид алюминия бурно реагирует с водой.
Алюминий напрямую не реагирует с водородом: металл образует соединения путем потери электронов, которые принимаются другими элементами. Атомы водорода не принимают электроны, которые отдают металлы для образования соединений. «Принуждать» атомы водорода принять электроны с образованием твердых ионных соединений (гидридов) могут только очень реактивные металлы (калий, натрий, магний, кальций). Для прямого синтеза гидрида алюминия из водорода и алюминия требуется огромное давление (около 2 миллиардов атмосфер) и температура выше 800 К. вы сможете узнать о химических свойствах других металлов.
Следует отметить, что - это единственный газ, заметно растворяющийся в алюминии и его сплавах. Растворимость водорода изменяется пропорционально температуре и квадратному корню из давления. Растворимость водорода в жидком алюминии значительно выше, чем в твердом. Это свойство незначительно изменяется в зависимости от химического состава сплавов.
Алюминий и его водородная пористость
 Алюминиевая пена
Алюминиевая пена
Образование в алюминии пузырей водорода непосредственно зависит от скорости охлаждения и затвердевания, а также от наличия центров зарождения для выделения водорода - захваченных внутрь расплава оксидов. Для образования пористости алюминия необходимо значительное превышение содержания растворенного водорода по сравнению с растворимостью водорода в твердом алюминии. При отсутствии центров зарождения для выделения водорода требуется относительно высокая концентрация вещества.
Расположение водорода в затвердевшем алюминии зависит от уровня его содержания в жидком алюминии и условий, при которых происходило затвердевание. Так как водородная пористость - это результат механизмов зарождения и роста, контролируемых диффузией, то такие процессы, как снижение концентрации водорода и увеличение скорости затвердевания, подавляют зарождение и рост пор. Из-за этого выполненные методом литья в разъемный кокиль отливки металла более подвержены дефектам, связанным с водородом, чем отливки, изготовленные методом литья под давлением.
Есть разные источники попадания водорода в алюминий .
Шихтовые материалы (лом, слитки, литейный возврат, оксиды, песок и смазки, применяющиеся при механической обработке). Эти загрязнители - потенциальные источники водорода, образовавшегося при химическом разложении паров воды или восстановлении органических веществ.
Плавильные инструменты . Скребки, пики, лопаты являются источником водорода. Оксиды и остатки флюсов на инструментах впитывают влагу из окружающего воздуха. Печные огнеупоры, распределительные каналы, ковши для отбора проб, известковые желоба и цементные растворы - потенциальные источники водорода.
Атмосфера печи . Если плавильная печь работает на мазуте или на природном газе, возможно неполное сгорание топлива с образованием свободного водорода.
Флюсы (гигроскопичные соли, готовые мгновенно впитывать воду). По этой причине влажный флюс неизбежно вносит в расплав водород, образовавшийся при химическом разложении воды.
Литейные формы . В процессе заполнения литейной формы жидкий алюминий течет турбулентно и захватывает воздух во внутренний объем. Если воздух не успеет выйти из формы до начала затвердевания алюминия, то водовод проникнет в металл.
Водород уже достаточно давно рассматривается и кое-где используется в качестве экологически чистого вида топлива . Но более широкому использованию водородного топлива мешает целый ряд неразрешенных на сегодняшний день проблем, главными из которых являются хранение и транспортировка. Однако, группа исследователей из американской Армейской научно-исследовательской лаборатории, проводя эксперименты на Абердинском испытательном полигоне близ Мериленда, сделала случайное открытие. Пролив воду на брусок особого алюминиевого сплава, состав которого держится пока в секрете, исследователи заметили мгновенно начавшийся процесс бурного выделения водорода.
Из школьного курса химии, если кто его еще помнит, водород является побочным продуктом реакции между водой и алюминием. Однако, данная реакция обычно протекает лишь при достаточно высокой температуре или в присутствии специальных катализаторов. Да и тогда она идет достаточно "неторопливо", на заполнение бака водородного автомобиля потребуется около 50 часов, а энергетическая эффективность такого метода получения водорода не превышает 50 процентов.
Все вышесказанное не имеет отношения к реакции, в которой принимает участие новый сплав алюминия. "Эффективность этой реакции вплотную приближается к 100 процентам, а сама реакция "разгоняется" до максимальной производительности менее, чем за три минуты" - рассказывает Скотт Грендаль (Scott Grendahl), руководитель научной группы.
Использование системы, вырабатывающей водород по мере необходимости, решает массу имеющихся проблем. Воду и алюминиевый сплав легко транспортировать из одного места в другое, оба этих вещества сами по себе инертны и стабильны. Во-вторых, для начала реакции не требуется никакого катализатора, ни первоначального толчка, реакция начинает идти сразу же, как вода входит в контакт со сплавом.
Все вышесказанное еще не означает, что исследователи обнаружили панацею в области водородного топлива. В этом деле существует еще целый ряд вопросов, подлежащих выяснению или уточнению. Первым вопросом является то, будет ли работать такая схема получения водорода вне лаборатории, ведь существует множество примеров, когда экспериментальные технологии отлично работают в лабораторных условиях, но терпят полную неудачу при полевых испытаниях. Вторым вопросом является вопрос сложности и стоимости производства алюминиевого сплава, стоимость утилизации продуктов реакции, которые станут факторами, определяющим экономическую целесообразность нового способа получения водорода.
И в заключение следует отметить, что на выяснение упомянутых выше вопросов, скорее всего, уйдет не так уж и много времени. И только после этого можно будет сделать выводы о дальнейшей жизнеспособности нового метода получения водородного топлива.
Водород - широко распространенный элемент. Благодаря своей уникальности он может выступать в качестве окислителя и в качестве восстановителя. Существует несколько методов получения водорода .
Промышленный метод получения водорода.
1. Электролиз водных растворов солей (поваренная соль NaCl ).
2. Пропускание паров поды над раскаленным коксом (Т = 1000 °С):
H 2 O + C = H 2 + CO ,
Реакция обратима!
Смесь (Н 2 , СО и Н 2 О ) называется водяным газом.
А на 2-ой стадии водяной газ пропускают над оксидом железа (III) при температуре около 450°С:
СО + Н 2 О = СО 2 + Н 2 ,
Часто эту реакцию называют реакцией сдвига.
3. Получение из природного газа. Основа - конверсия метана (основной компонент природного газа, СН 4 ) с водяным паром. В итоге получается обратимая смесь, которая называется синтез-газом. Условия протекания процесса: никелевый катализатор и 1000°С:
СН 4 + Н 2 О = СО 2 + 3Н 2 ,
Эту реакцию часто используют для получения водорода для реакции Габера (синтез аммиака).
4. Крекинг нефтяных продуктов.
Лабораторный метод получения водорода.
1. Под воздействием разбавленных кислот на металлы, которые стоят в ряду напряжения левее водорода.
Zn + HCl = ZnCl 2 + H 2 ,
2. Электролиз растворов кислот, щелочей на катоде выделяется водород.
3. Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H 2 O = 2Na + 3H 2
4. Гидролиз гидридов:
NaH + H 2 O = NaOH + H 2 ,
5. Реакция кальция с водой:
Ca + 2H 2 O = Ca(ОН) 2 + H 2 .
«Водород генерируется только при необходимости, так что вы можете произвести его ровно столько, сколько нужно», - пояснил Вудалл на университетском симпозиуме, где описывались детали открытия. Данная технология может, например, применяться совместно с небольшими двигателями внутреннего сгорания в различных применениях – портативных аварийных генераторах, газонокосилках и пилах. Теоретически, она может быть использована и на легковых автомобилях и грузовиках.
Водород выделяется самопроизвольно, когда вода добавляется к шарикам, выполненным из сплава алюминия и галлия. «При этом алюминий в твердом сплаве реагирует с водой, отрывая от ее молекул кислород», - комментирует Вудалл. Соответственно, оставшийся водород выделяется в окружающее пространство.
Наличие галлия является критичным для прохождения реакции, так как он препятствует формированию пленки оксида на поверхности алюминия при его окислении. Такая пленка обычно предотвращает дальнейшее окисления алюминия, выступая в качестве барьера. Если же ее формирование окажется нарушенным, реакция будет идти до тех пор, пока не израсходуется весь алюминий.
Вудалл открыл данный процесс с жидким сплавом алюминия-галлия в 1967 году, когда он работал в полупроводниковой промышленности. «Я очищал тигель, содержавший сплав галлия и алюминия, - рассказывает он, - Когда я добавил туда воду, произошел сильный хлопок. После этого я удалился в лабораторию и в течение нескольких часов изучал, что же именно произошло».
«Необходимым компонентом является галлий, так как он плавится при низкой температуре и растворяет алюминий, что делает возможным реакцию последнего с водой. – поясняет Вудалл. – Это было неожиданным открытием, так как хорошо известно, что твердый алюминий не взаимодействует с водой».
Конечными продуктами реакции являются галлий и оксид алюминия. Сжигание же водорода приводит к образованию воды. «Таким образом, никаких токсичных выбросов не получается, - говорит Вудалл, - Важно отметить и то, что галлий не участвует в реакции, так что его можно утилизировать и использовать вновь. Это важно, так как сейчас этот металл намного дороже алюминия. Впрочем, если данный процесс начнет широко использоваться, то добывающая промышленность сможет выпускать более дешевый низкосортный галлий. Для сравнения, весь используемый сейчас галлий имеет высокую степень очистки и используется, главным образом, в полупроводниковой промышленности».
Вудалл говорит, что, так как водород может использоваться вместо бензина в двигателях внутреннего сгорания, возможно применение методики на автомобильном транспорте. Однако для того, чтобы технология смогла конкурировать с бензиновой, необходимо снизить стоимость восстановления оксида алюминия. «Сейчас стоимость одного фунта алюминия превышает $1, и поэтому вы не сможете получить количество водорода, эквивалентное бензину по цене $3 за галлон», - поясняет Вудалл.
Впрочем, стоимость алюминия может быть снижения, если он будет получаться из оксида с помощью электролиза, а электроэнергия для него будет идти с или . В этом случае алюминий может производиться прямо на месте, и отпадает необходимость в передаче электроэнергии, что снижает общие затраты. Кроме того, такие системы могут располагаться в удаленных районах, что особенно важно при постройке атомных электростанций. Данный подход, по мнению Вудалла, позволит уменьшить использование бензина, снизить загрязнение и зависимость от импорта нефти.
«Мы называем это водородной энергетикой на основе алюминия, - говорит Вудалл, - Причем не будет никаких сложностей, чтобы переделать двигатели внутреннего сгорания на работу от водорода. Все, что нужно – заменить их топливный инжектор на водородный».
Также система может применяться и для питания топливных ячеек. В этом случае она уже может конкурировать с бензиновыми двигателями – даже при сегодняшней высокой стоимости алюминия. «КПД систем на топливных элементах составляет 75%, тогда как двигателя внутреннего сгорания – 25%, - говорит Вудалл, - Таким образом, как только технология будет широко доступной, наша методика извлечения водорода станет экономически оправданной».
Ученые подчеркивают ценность алюминия для генерации энергии. «Большинство людей не догадывается, насколько много энергии заключено в нем, - поясняет Вудалл, - Каждый фунт (450 граммов) металла может дать 2 кВт*часа при сжигании выделившегося водорода, и еще столько же энергии в виде тепла. Таким образом, средний автомобиль с баком, заполненным шариками из сплава алюминия (около 150 кг) сможет проехать порядка 600 км, и это будет стоить $60 (при этом предполагается, что оксид алюминия затем будет утилизирован). Для сравнения, если я залью в бак бензин, то буду получать с каждого фунта 6 кВт*часов, что в 2.5 раза больше энергии от фунта алюминия. Другими словами, мне нужно будет в 2.5 раза больше алюминия, чтобы получить такое же количество энергии. Однако важно то, что я полностью исключаю бензин, и применяю вместо него дешевое вещество, доступное в США».